人教版高一化学第一章第一节《化学实验基本方法》教案(带课堂视频)
第一章 归纳与整理
第一课时
教学目的:
1、 复习巩固初中学习的基本操作
2、 复习巩固过滤、蒸发、蒸馏、萃取基本操作及注意事项
3、 建立从实验学化学的观点。
教学重点:
巩固过滤、蒸发、蒸馏、萃取基本操作及注意事项
教学过程:
[归纳整理]P17:一、混合物分离与提纯,填上分离的物质及应用举例及二、离子的检验。并交流答案。
[板书] 归纳与整理
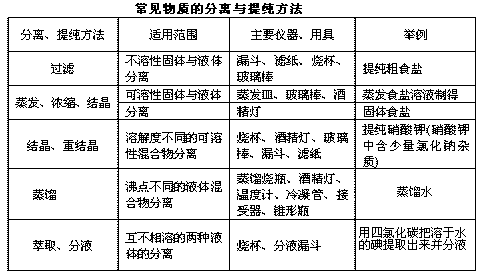
一、混合物分离与提纯
[投影]
[讲述] 物质的分离是把混合物中各物质经过物理(或化学)变化,将其彼此分开的
过程,分开后各物质要恢复到原来的状态;物质的提纯是把混合物中的杂质除去,以得到纯物质的过程。
[ 思考] 物质的分离与提纯常用的物理方法。
[提问]过滤、蒸馏注意事项
[讲述] 1、过滤操作应注意做到“一贴、二低、三接触”,如图:
①“一贴”:折叠后的滤纸放入漏斗后,用食指按住,加入少量蒸馏水润湿,使之紧贴在漏斗内壁,赶走纸和壁之间的气泡。
②“二低”:滤纸边缘应略低于漏斗边缘;加入漏斗中液体的液面应略低于滤纸的边缘(略低约 1cm),以防止未过滤的液体外溢。
③“三接触”:漏斗颈末端与承接滤液的烧杯内壁相接触;使滤液沿烧杯内壁流下;向漏斗中倾倒液体时,要使玻璃棒一端与滤纸三折部分轻轻接触;承接液体的烧杯嘴和玻璃棒接触,使欲过滤的液体在玻棒的引流下流向漏斗。过滤后如果溶液仍然浑浊,应重新过滤一遍。如果滤液对滤纸有腐蚀作用,一般可用石棉或玻璃丝代替滤纸。如果过滤是为了得到洁净的沉淀物,则需对沉淀物进行洗涤,方法是:向过滤器里加入适量蒸馏水,使水面浸没沉淀物,待水滤去后,再加水洗涤,连续洗几次,直至沉淀物洗净为止。
[板书] 1、过滤操作应注意做到“一贴、二低、三接触”
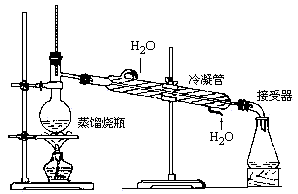
[投影]
①蒸馏烧瓶中所盛液体不能超过其容积的2/3,也不能少于1/3;
②温度计水银球部分应置于蒸馏烧瓶支管口下方约0.5cm处;
③冷凝管中冷却水从下口进,上口出;
④为防止爆沸可在蒸馏烧瓶中加入适量碎瓷片;
⑤蒸馏烧瓶的支管和伸入接液管的冷凝管必须穿过橡皮塞,以防止馏出液混入杂质;
⑥加热温度不能超过混合物中沸点最高物质的沸点。
[思考与讨论] 蒸馏与蒸发的区别
[提问]蒸馏与蒸发的区别:加热是为了获得溶液的残留物(浓缩后的浓溶液或蒸干后的固体物质)时,要用蒸发;加热是为了收集蒸气的冷凝液体时,要用蒸馏。
[讲述]蒸发操作应注意的事项:注意蒸发皿的溶液不超过蒸发皿容积的2/3;加热过程中要不断搅拌,以免溶液溅出;如果蒸干,当析出大量晶体时就应熄灭酒精灯,利用余热蒸发至干。
[投影]
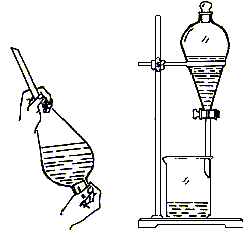
[讲述并板书]3、萃取的操作方法如下:
①用普通漏斗把待萃取的溶液注入分液漏斗,再注入足量萃取液;
②随即振荡,使溶质充分转移到萃取剂中。振荡的方法是用右手压住上口玻璃塞,左手握住活塞部分,反复倒转漏斗并用力振荡;
③然后将分液漏斗置于铁架台的铁环上静置,待分层后进行分液;
④蒸发萃取剂即可得到纯净的溶质。为把溶质分离干净,一般需多次萃取。
(6)分液的操作方法:
①用普通漏斗把要分离的液体注入分液漏斗内,盖好玻璃塞;
②将分液漏斗置于铁架台的铁圈上,静置,分层;
③将玻璃塞打开,使塞上的凹槽对准漏牛口上的小孔再盖好,使漏斗内外空气相通,以保证漏斗里的液体能够流出;
④打开活塞,使下层液体慢慢流出,放入烧杯,待下层液体流完立即关闭活塞,注意不可使上层液体流出;
⑤从漏斗上端口倒出上层液体。
[学生讨论]化学方法提纯和分离物质的“四原则”和“三必须”
[讲述](1)“四原则”是:一不增(提纯过程中不增加新的杂质);二不减(不减少欲被提纯的物质);三易分离(被提纯物与杂质容易分离);四易复原(被提纯物质要复原)。
(2)“三必须”是:一除杂试剂必须过量;二过量试剂必须除尽(因为过量试剂带入新的杂质);三除杂途径选最佳。
例题
[例题1] 除去下列物质中的杂质,所用试剂和方法不正确的是
物质 杂质 除杂所用试剂和方法
A.H2SO4 HCl AgNO3溶液、过滤
B.KNO3 K2SO4 Ba(NO3)2溶液、过滤
C.Cu CuO 盐酸、过滤
D.CaCO3 CaO H2O、过滤
[分析] 除杂——将杂质除去并进行有效的分离.因此,所加试剂与杂质反应后生成的产物应易于分离而除去.将杂质转化为难溶物或转化为可溶(非杂质难溶时)物而通过过滤方法除去。A中可产生Ag2SO4 沉淀,所以A不正确。
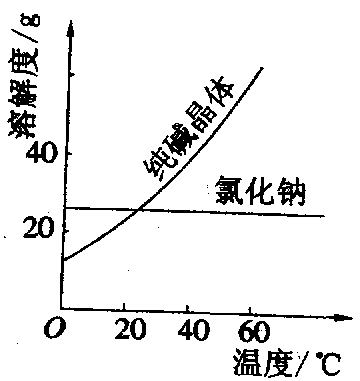
[例2] 根据图所示的溶解度曲线,回答下列问题.
(1)氯化钠和纯碱晶体均属于 _____物质(填“易溶”、“可溶”、“微溶”或“难溶”).
(2)我国某些盐湖里出产天然碱(主要成分为纯碱晶体,并含少量氯化钠杂质).在实验室里从天然碱中分离出较纯的纯碱晶体,应采用______的方法(杂质仅考虑氯化钠).
(3)具体的实验操作步骤:①加热溶解,②_________,③_________,④洗涤晾干.
(4)完成①~③必备的实验仪器有铁架台(附铁圈、石棉网等)、烧杯、玻璃棒和_________、____________等.
[剖析] 这是一道根据物质溶解度曲线进行物质分离的综合题.命题人将判断物质的溶解性范围与分离方法、实验操作融入同一道试题中,比较全面的考查了有关物质结晶分离的知识.本题导向我们的复习既要注意掌握学科知识点,又要注意知识的灵活应用.
[答案] (1)易溶 (2)冷却热饱和溶液(3)结晶 过滤(4)漏斗 酒精灯
课堂练习
一、
(1)水资源非常重要,联合国确定2003年为国际淡水年。下列关于水的说法中错误的是
A. 蒸馏法是海水淡化的方法之一 B. 淡水的密度小于海水的密度
C. 融化的雪水中矿物质含量比深井水中的少
D. 0℃以上,温度越高,水的密度越小
(2)分离FeCl3、KCl、BaSO4的因体混合物,应采用的一组试剂是:
A.水、硝酸银、稀硝酸 B.水、氢氧化钠、盐酸
C.水、氢氧化钾、盐酸 C.水、氢氧化钾、硫酸
(3)下列所列三种物质都含有少量杂质,试在表中相应的空格内分别除去杂质应选用的试剂和方法,及有关化学反应方程式.
|
物质 |
杂质 |
除去杂质所选用的试剂和方法 |
反应的化学方程式 |
|
NaNO3 |
NaCl |
|
|
|
ZnSO4 |
CuSO4 |
|
|
(4)如何除去H2中混有的HCl气体和水蒸气?
二、实验室思维拓展有一瓶亚硫酸钠试剂,有部分己被氧化成硫酸钠.某学生设计了下列实验来测定其中Na2SO4的质量分数.
(1)称取样品a克,并溶解在一定量的水中.
(2)往溶液中加盐酸(2HCl+Na2SO3 = 2NaCl+SO2+H2O),直至盐酸过量.
(3)往酸化的溶液中加入过量的BaCl2溶液.
(4)过滤,并洗涤.烘干得沉淀b克.
试回答:
(1)加盐酸为什么要过量
(2)如何验证氯化钡已经过量?
(3)怎样检验沉淀已经洗涤干净?
(4)列计算亚硫酸钠的质量分数的代数式
参考答案:
一.(1)D(2)C (3)加入AgNO3,过滤.蒸发 NaCl+AgNO3 = AgCl+NaNO3
(4)将混合气体通过NaOH溶液除去HCl, 然后通过浓H2SO4除去H2O
二、(1)使SO32-全部转化为SO2放出;(2)取上层清液滴加稀H2SO4,若有白色沉淀产生则已过量; (3)取洗涤淀的溶液滴AgNO3液,若无白色沉淀产生则已洗净.
[板书设计] 归纳与整理
一、混合物分离与提纯
1、 过滤操作应注意做到“一贴、二低、三接触”
2、 蒸馏操作应注意的事项①②③④⑤⑥
3、 萃取的操作方法
分液操作方法
第一节 化学实验基本方法 (1)
班级___________姓名_______________学号______
开头的话:实验是化学的灵魂,实验是化学前进的台阶,实验是学习化学的重要手段。认识实验安全的重要性,树立严谨的科学实验态度,掌握正确的科学实验方法,对于每一个同学尤为重要。
一、混合物的分离和提纯
【思考与交流】
1、俗话说:“吹尽黄沙始见金”,你知道淘金者怎样将金子从沙中淘出来的吗?
2、如果有铁屑和沙的混合物,你能用哪些方法将铁屑分离出来?
3、分离和提纯物质时要除掉杂质,化学上所指的杂质都是有害和无价值的吗?试举例说明。
【分离与提纯的四种重要方法】
1、____________2、_____________3、___________4、_____________
1、过滤
(1)过滤的适用范围_________________________________________
(2)过滤所用仪器___________________________________________
(3)过滤注意事项
“一贴二低三靠”, 紧贴漏斗;滤纸边缘低于 ,漏斗中液面低于 ;倾倒液体的烧杯紧靠 ,玻璃棒的末端靠在 ,漏斗下端管口紧靠 。若滤液浑浊,再 一次。
(4)试举例______________________________________________________
2、蒸发
(1)蒸发的适用范围________________________________________
(2)蒸发所用仪器_________________________________________
(3)蒸发溶液过程中要注意的问题
蒸发溶液的过程中,要用 不断搅拌,以免溶液 ,当蒸发皿中出现 时停止加热。
(4)试举例____________________________________________________-
3、蒸馏
(1)蒸馏的适用范围______________________________________________
(2)蒸馏的装置
(3)蒸馏所用仪器_____________________________________________________
(4)蒸馏要注意事项
温度计的水银球置于蒸馏烧瓶的 处,冷凝管中冷凝水由 处进,从
处出。蒸馏烧瓶在加热时要垫上 ,加入 是为了防止液体暴沸。
(5)试举例____________________________________________________
4、萃取(分液)
(1)什么是萃取?__________________________________________________________
_____________________________________________________________________________
(2)萃取所用的仪器________________________________________
(3)萃取注意事项
萃取剂要求与原溶剂 ,不与被萃取的物质发生 ,与原溶剂的 差异较大,被萃取物质在萃取剂中有较大 。加入萃取剂后要充分 ,使两种互不相溶的液体充分接触,提高萃取效率。
萃取碘的饱和溶液的萃取剂可以是_______________________________________
(4)分液注意事项
打开分液漏斗上口玻璃塞或将塞上凹槽与漏斗口的小孔相对,使漏斗内气压与外界 ,便于漏斗内液体流下来。将分液漏斗下面的活塞打开,使 层液体慢慢流出, 上层液体从分液漏斗的上口倒出。
二、化学实验安全
1、取用药品的安全注意事项:
(1)不能用 接触药品,不要把鼻孔 去闻药品(特别是气体)的气味,不得 任何药品的味道。
(2)注意节约药品。应该严格按照实验规定的用量取用药品。如果没有说明用量,一般按最少量取用:液体 ,固体只需 。
(3)实验剩余的药品既不能放回 ,也不要随意丢弃,更不要拿出 ,要放入
内。
2、用酒精灯加热的安全注意事项
(1)在使用前,要检查灯里有无酒精。向灯内添加酒精时,不能超过酒精灯容积的 。
(2)在使用时要注意几点:绝对禁止向燃着的酒精灯里添加酒精,以免 ;绝对禁止用酒精灯 另一只酒精灯;必须用 盖灭,不可用 去吹。不要碰倒酒精灯,万一洒出的酒精在桌上燃烧起来,不要惊慌,应立即用 。
(3)如果被加热的玻璃容器外壁有水,应在加热前 ,然后加热;对烧瓶、烧杯、锥形瓶等加热时还要垫 ,以免容器炸裂;给试管里的药品加热,必须先进行 ,以免试管炸裂;如果给试管里的液体加热,液体体积不要超过试管容积的 ,试管口以约 角向上倾斜,但不可让试管口对着自己或他人的方向,以免液体 喷出伤人;如果给试管里的固体加热,试管口应 ,以免试管内有水倒流炸裂试管。
(4)烧得很热的玻璃容器,不要立即用 冲洗,否则可能破裂;也不要直接放在实验台上,以免 实验台。更不要直接用 去拿,否则会被烫伤。
3、遵守实验室规则。
4、了解安全措施。画出爆炸品、氧化剂、剧毒品、腐蚀品的标志图标:
三、阅读材料:实验安全与事故处理
(1)实验安全
● 防止火灾
化学药品中有很多是易燃物,在使用时若不注意可能酿成火灾。所以,对易燃物:① 必须妥善保管,放在专柜中,远离火源。易燃品、强氧化剂、钾、钠、钙等强还原剂要妥善保管;② 使用易挥发可燃物如乙醇、乙醚、汽油等应防止蒸气逸散,添加易燃品一定要远离火源;③ 进行加热或燃烧实验时要严格操作规程和仪器选用,如蒸馏时要用冷凝器等;④ 易燃物质用后若有剩余,决不能随意丢弃,如残留的金属钠应用乙醇处理,白磷应放在冷水中浸泡等。
另外,实验室必须配备各种灭火器材(酸碱灭火器、四氯化碳灭火器、粉末灭火器、沙子、石棉布、水桶等)并装有消防龙头。实验室电器要经常检修,防止电火花、短路、超负载等引发火灾。
在使用酒精灯时,一定要注意:① 不能用燃着的酒精灯去点燃另一盏酒精灯;② 不能用嘴吹灭酒精灯;③ 不能向燃着的酒精灯中添加酒精;④ 灯壶内的酒精不能超过容积的2/3等。
● 灭火
如果不慎在实验室发生火灾,应立即采取以下措施:
① 防止火势扩展:移走可燃物,切断电源,停止通风。② 扑灭火源:酒精等有机溶剂泼洒在桌面上着火燃烧,用湿布、石棉或沙子盖灭,火势大可以用灭火器扑灭。小范围的有机物、钾、钠、白磷等化学物质着火可用沙盖灭。③ 常用灭火器的种类和使用范围见下表:
|
类 型 |
药液成分 |
适用灭火对象 |
|
酸碱式 |
H2SO4和NaHCO3 |
非油类、电器 |
|
泡沫式 |
Al2(SO4)3和NaHCO3 |
油类 |
|
CO2灭火器 |
液态CO2电 |
器、小范围油类、忌水的化学品 |
|
四氯化碳 |
液态四氯化碳 |
电器、汽油、丙酮。不能用于钾、钠、电石、CS2 |
|
干粉灭火器 |
NaHCO3等类,适量润滑剂、防潮剂 |
油类、可燃气体、精密仪器、图书文件等 |
扑救化学火灾注意事项:
① 与水发生剧烈反应的化学药品不能用水扑救,如钾、钠、钙粉、镁粉、铝粉、电石、PCl3、PCl5、过氧化钠、过氧化钡、磷化钙等,它们与水反应放出氢气、氧气等将引起更大火灾。
② 比水密度小的有机溶剂,如苯、石油等烃类、醇、醚、酮、酯类等着火,不能用水扑灭,否则会扩大燃烧面积;比水密度大且不溶于水的有机溶剂,如二硫化碳等着火,可用水扑灭,也可用泡沫灭火器、二氧化碳灭火器扑灭。
③ 反应器内的燃烧,如是敞口器皿可用石棉布盖灭。蒸馏加热时,如因冷凝效果不好,易燃蒸气在冷凝器顶端燃着,绝对不可用塞子或其他物件堵塞冷凝管口,应先停止加热,再行扑救,以防爆炸。
● 防止爆炸
各种可燃气体与空气混合都有一定的爆炸极限,点燃气体前,一定要先检验气体的纯度。特别是氢气,在点燃氢气或加热与氢气反应的物质前,都必须检验其纯度。
● 防止倒吸引起爆裂
加热制备气体并将气体通入溶液中的实验,要防止因反应容器内压强锐减而造成液体倒吸入热的反应容器内。玻璃的膨胀系数比较小,冷热不均会造成玻璃容器爆裂,甚至溅伤实验人员。为此,要注意以下几点:① 加热尽可能均匀;② 在反应容器后加一个安全瓶;③ 用倒扣漏斗等方法吸收易溶于水的气体;④ 实验结束前先从溶液中撤出导管再停止加热。
● 防止有害气体污染空气
有毒气体如Cl2、HCl、H2S、SO2、NO2等酸性气体,用强碱溶液吸收(通常用浓NaOH溶液);CO点燃除掉;NO先与足量空气混合后再通入碱溶液中;H2和其他可燃性气体,如气态烃虽无毒性,但弥散在空气中有着火或爆炸的危险,应当点燃除掉;NH3用浓硫酸吸收;制备有毒气体的实验应在通风橱内进行。
● 防止暴沸
加热有机物时,由于它们的沸点一般比较低,一旦温度过高,液体局部过热,会形成暴沸现象,反应溶液甚至冲开橡皮塞溅伤实验者,所以,在反应容器中要放一些碎瓷片。
● 严格按照实验规程进行操作
药品用量要尽可能少,如金属钾与水反应,钾的用量控制为绿豆般大小。用量过大,反应十分激烈会引起燃烧甚至爆炸。烧瓶内反应溶液的体积一般不宜超过瓶容积的一半,以防冲出瓶外。加热应控制在规定的温度范围内,特别是有机反应,如酯的制备要用小火加热等。易燃试剂在实验时远离热源;取用试剂后及时塞好瓶塞;稀释浓硫酸一定要将浓硫酸沿器壁慢慢倒入水中并不断搅拌。闻气体的气味时要用手轻轻扇动,让极少量气体飘进鼻孔等。
(2)意外事故的处理方法
● 创伤急救
用药棉或纱布把伤口清理干净,若有碎玻璃片要小心除去,用双氧水擦洗或涂红汞水,也可涂碘酒(红汞与碘酒不可同时使用),再用创可贴外敷。
● 烫伤和烧伤的急救
可用药棉浸75%~95%的酒精轻涂伤处,也可用3%~5%的KMnO4溶液轻擦伤处到皮肤变棕色,再涂烫伤药膏。
● 眼睛的化学灼伤
应立即用大量流水冲洗,边洗边眨眼睛。如为碱灼伤,再用20%的硼酸溶液淋洗;若为酸灼伤,则用3%的NaHCO3溶液淋洗。
● 浓酸和浓碱等强腐蚀性药品
使用时应特别小心,防止皮肤或衣物被腐蚀。如果酸(或碱)流在实验桌上,立即用NaHCO3溶液(或稀醋酸)中和,然后用水冲洗,再用抹布擦干。如果只有少量酸或碱液滴到实验桌上,立即用湿抹布擦净,再用水冲洗抹布。
如果不慎将酸沾到皮肤或衣物上,立即用较多的水冲洗,再用3%~5%的NaHCO3溶液冲洗。如果是碱溶液沾到皮肤上,要用较多的水冲洗,再涂上硼酸溶液。
● 其他化学灼伤的急救
溴:用1体积氨水+1体积松节油+10体积乙醇混合处理。
磷:先用5%的CuSO4溶液洗,再用1 g/L的KMnO4溶液湿敷。
苯酚:先用大量水洗,再用乙醇擦洗,最后用肥皂水、清水洗涤。
(3)妥善处理实验后的废液和废渣
化学实验的废液大多数是有害或有毒的,不能直接排到下水管道中,可先用废液缸收集储存,以后再集中处理。但一些能相互反应产生有毒物质的废液不能随意混合,如强氧化剂与盐酸、硫化物、易燃物,硝酸盐和硫酸,有机物与过氧化物,磷和强碱(产生PH3),亚硝酸盐和强酸(产生HNO2),MnO2、KMnO4、KClO3等不能与浓盐酸混合;挥发性酸与不挥发性酸等。
常见废液的处理方法见下表:
|
废 液 |
处理方法 |
注意事项 |
|
酸或碱 |
中和法 |
分别收集,混合无危险时将废酸、废碱混合 |
|
氧化剂 |
氧化还原法 |
分别收集,查明废液化学性质,将一种废液分次少量加入另一种废液中 |
|
含重金属离子的废液 |
氢氧化物沉淀法,硫化物共沉淀法 |
用过滤或倾析法将沉淀分离,滤液不含重金属离子后再排放 |
|
含Ba2+ |
沉淀法 |
加入Na2SO4溶液,过滤,除去沉淀即可排放 |
|
有机物 |
焚烧法,有机溶剂萃取回收利用 |
生成水、CO2等不污染环境 |
固体残渣往往有一些重金属盐,对水体和土壤会造成污染,要处理(一般变成难溶的氧化物或氢氧化物)后集中掩埋。汞不慎撒落地面时,要先用硫黄覆盖,使其化合为硫化汞后扫除并妥善掩埋。用剩下的钠、钾、白磷等易燃物,氧化剂KMnO4、KClO3、Na2O2等,易挥发的有机物等不可随便丢弃,防止着火事件发生。有毒物质用剩后不可随意乱扔。
(资料1摘编自《化学中的探索──发现式实验手册》,高华;《高三化学实验》,孙雪冰、宋国建)
| 感动 | 同情 | 无聊 | 愤怒 | 搞笑 | 难过 | 高兴 | 路过 |
相关文章
-
没有相关内容


 会员登录
会员登录